- Home
- Bloguri
- Descopera produse
- Vitamine, minerale si suplimente
- Cuplu si sex
- Produse de slabit
- Medicamente
- Special la Catena
- Tehnico - medicale
- Frumusete si ingrijire
- Mama si copilul
- Acnee
- Diverse
- Nutritie sanatoasa
- Produse naturiste
- Medicamente fertilitate
- Produse BIO
- Idei de cadouri
- NOU la Catena
- Alimente cu destinatie speciala
- Ce Oftapic ti se potriveste
- Adora – Adorabili din prima clipa
- oferte
- card club
- prospecte
- Catalogul lunii
Imarsa 250 mg x 2 ser. preumpl. + 2 ace x 5 ml sol. inj.
Prospect Imarsa 250 mg x 2 ser. preumpl. + 2 ace x 5 ml sol. inj.
AUTORIZATIE DE PUNERE PE PIATA NR. 13586/2020/01-02-03
Anexa 1
Prospect
Prospect: Informatii pentru utilizator
IMARSA 250 mg solutie injectabila in seringa preumplutaa
fulvestrant
Cititi cu atentie si in intregime acest prospect inainte de a incepe sa luati acest medicament, deoarece contine informatii importante pentru dumneavoastra.
- Pastrati acest prospect. S-ar putea sa fie necesar sa-l recititi.
- Daca aveti orice intrebari suplimentare, adresati-va medicului dumneavoastra, farmacistului sau asistentei medicale.
- Acest medicament a fost prescris numai pentru dumneavoastra. Nu trebuie sa-l dati altor persoane. Le poate face rau, chiar daca au aceleasi semne de boala ca dumneavoastra.
- Daca manifestati orice reactii adverse, adresati-va medicului dumneavoastra , farmacistului sau asistentei medicale. Acestea includ orice posibile reactii adverse, nementionate in acest prospect. Vezi pct. 4.
Ce gasiti in acest prospect:
1. Ce este Imarsa si pentru ce se utilizeaza
2. Ce trebuie sa stiti inainte sa luati Imarsa
3. Cum vi se va administra Imarsa
4. Reactii adverse posibile
5. Cum se pastreaza Imarsa
6. Continutul ambalajului si alte informatii
1. Ce este Imarsa si pentru ce se utilizeaza
Imarsa contine substanta activa fulvestrant, care apartine grupului blocantilor estrogenici. Estrogenii, un tip de hormoni sexuali feminini, sunt implicati, in unele cazuri, in aparitia cancerului de san.
Imarsa este utilizat fie:
- In monoterapie in tratamentul unui tip de cancer de san denumit cancer de san pozitiv pentru receptorul de estrogen, care este avansat local sau s-a raspandit la alte parti ale corpului (metastazat), la femeile aflate in postmenopauza, sau
- In combinatie cu palbociclib pentru a trata femeile cu un tip de cancer de san denumit cancer de san pozitiv pentru receptorul pentru hormoni, negativ pentru receptorul 2 al factorului de crestere epidermala, care este avansat local sau s-a raspandit (metastazat). Femeile care nu au ajuns la menopauza vor fi tratate si cu un medicament denumit agonist al hormonului eliberator de hormon luteinizant (LHRH).
Atunci cand Imarsa se administreaza in combinatie cu palbociclib, este important sa cititi si prospectul pentru palbociclib. Daca aveti orice intrebari despre palbociclib, adresati-va medicului dumneavoastra.
2. Ce trebuie sa stiti inainte sa luati Imarsa
Nu trebuie sa vi se administreze Imarsa
- daca sunteti alergic la fulvestrant sau la oricare dintre celelalte componente ale acestui medicament (enumerate la punctul 6)
- daca sunteti gravida sau alaptati
- daca aveti afectiuni severe ale ficatului.
Atentionari si precautii
Inainte de a vi se administra Imarsa, adresati-va medicului dumneavoastra, sau farmacistului sau asistentei medicale daca vreuna dintre aceste situatii se aplica in cazul dumneavoastra:
- Afectiuni ale rinichilor sau ficatului
- Numar de trombocite (celule care ajuta la coagularea sangelui) scazut sau afectiuni hemoragice
- Probleme cu cheagurile de sange in antecedente
- Osteoporoza (scadere a densitatii osoase)
- Alcoolism.
Copii si adolescenti
Imarsa nu este destinat utilizarii la copii si adolescenti cu varsta sub 18 ani.
Imarsa impreuna cu alte medicamente
Spuneti medicului dumneavoastra sau farmacistului daca luati, ati luat recent sau s-ar putea sa luati orice alte medicamente.
In mod special, trebuie sa spuneti medicului dumneavoasta daca utilizati anticoagulante (medicamente care previn coagularea sangelui).
Sarcina si alaptarea
Nu trebuie sa vi se administreze Imarsa daca sunteti gravida. Daca exista posibilitatea sa ramaneti gravida, trebuie sa utilizati metode contraceptive eficace in timp ce sunteti tratata cu Imarsa si timp de doi ani dupa administrarea ultimei doze.
Nu trebuie sa alaptati in timpul tratamentului cu Imarsa.
Conducerea vehiculelor si folosirea utilajelor
Nu este de asteptat ca Imarsa sa va afecteze capacitatea de a conduce vehicule sau de a folosi utilaje. Cu toate acestea, daca dupa tratament va simtiti obosita, nu conduceti vehicule si nu folositi utilaje.
Imarsa contine alcool (alcool etilic) 500 mg in fiecare injectie, echivalentul a 100 mg/ml (10% m/v). Cantitatea din fiecare seringa preumpluta este echivalenta cu 13 ml bere sau 5 ml vin.
Cantitatea de alcool din acest medicament nu poate avea efect la adulti si adolescenti.
Cantitatea de alcool din acest medicament poate modifica efectele altor medicamente. Adresati-va medicului dumneavoastra sau farmacistului daca luati alte medicamente.
Daca sunteti gravida sau alaptati, adresati-va medicului sau farmacistului inainte de a lua acest medicament.
Daca sunteti dependenta de alcool, adresati-va medicului sau farmacistului inainte de a lua acest medicament.
Imarsa contine alcool benzilic 500 mg per injectie, echivalent cu 100 mg/ml. Alcoolul benzilic poate cauza reactii alergice.
Imarsa contine benzoat de benzil 750 mg per injectie, echivalent cu 150 mg/ml.
3. Cum vi se va administra Imarsa
Medicul sau asistenta medicala va va administra Imarsa ca o injectie intramusculara lenta, una in fiecare fesa.
Doza recomandata este de 500 mg fulvestrant (doua injectii a cȃte 250 mg/5 ml) administrate o data pe luna, cu o doza suplimentara de 500 mg administrata la 2 saptamani de la doza initiala.
Daca aveti orice intrebari suplimentare cu privire la acest medicament, adresati-va medicului dumneavoastra, farmacistului sau asistentei medicale.
4. Reactii adverse posibile
Ca toate medicamentele, acest medicament poate provoca reactii adverse, cu toate ca nu apar la toate persoanele.
Reactii adverse grave
Este posibil sa aveti nevoie de tratament medical imediat daca prezentati oricare dintre urmatoarele reactii adverse:
- Reactii alergice (hipersensibilitate) inclusiv umflare a fetei, a buzelor, a limbii si/sau a gatului, care pot fi semne ale reactiilor anafilactice
- Tromboembolism (risc crescut de formare a cheagurilor de sange)*
- Inflamatie a ficatului (hepatita)
- Insuficienta hepatica.
Daca manifestati oricare dintre urmatoarele reactii adverse, adresati-va medicului dumneavoastra, farmacistului sau asistentei medicale:
Reactii adverse foarte frecvente (pot afecta mai mult de 1 din 10 persoane)
- Reactii la locul de injectare, cum ar fi durere si/sau inflamatie
- Valori anormale ale enzimelor ficatului (in testele de sange)*
- Greata (senzatie de rau)
- Slabiciune, oboseala*
- Dureri articulare si musculo-scheletice
- Bufeuri
- Eruptii trecatoare pe piele
- Reactii alergice (hipersensibilitate), inclusiv umflare a fetei, a buzelor, a limbii si/sau a gatului.
Alte reactii adverse:
Reactii adverse frecvente (pot afecta pana la 1 din 10 persoane):
- Durere de cap
- Varsaturi, diaree sau lipsa poftei de mancare*
- Infectii ale tractului urinar
- Dureri de spate*
- Crestere a bilirubinei (pigment biliar produs de ficat)
- Tromboembolism (risc crescut de formare a cheagurilor de sange)*
- Scadere a numarului plachetelor sanguine (trombocitopenie)
- Sangerari vaginale
- Durere lombara care iradiaza spre picior, pe o parte (sciatica)
- Stare de slabiciune instalata brusc, amorteala, furnicaturi sau pierderea mobilitatii piciorului, in special pe o parte a corpului, probleme la mers si cu mentinerea echilibrului, brusc instalate (neuropatie periferica).
Reactii adverse mai putin frecvente (pot afecta pana la 1 din 100 persoane)
- Secretie vaginala cu consistenta crescuta, albicioasa si candidoza (infectie).
- Vanatai si sangerari la locul injectarii
- Crestere a gama-GT, enzima a ficatului care poate fi determinata in testele de sange
- Inflamatie a ficatului (hepatita)
- Insuficienta hepatica
- Amorteala, furnicaturi si durere
- Reactii anafilactice.
*Include reactii adverse pentru care rolul exact al Imarsa nu a putut fi evaluat din cauza bolii de baza.
Raportarea reactiilor adverse
Daca manifestati orice reactii adverse, adresati-va medicului dumneavoastra sau farmacistului. Acestea includ orice reactii adverse nementionate in acest prospect. De asemenea, puteti raporta reactiile adverse direct prin intermediul sistemului national de raportare, ale carui detalii sunt publicate pe web-site-ul Agentiei Nationale a Medicamentului si a Dispozitivelor Medicale din Romania http://www.anm.ro/.
Agentia Nationala a Medicamentului si a Dispozitivelor Medicale din Romania
Str. Aviator Sanatescu nr. 48, sector 1
Bucuresti 011478- RO
Tel: + 4 0757 117 259 Fax: +4 0213 163 497 e-mail: adr@anm.ro.
Raportand reactiile adverse, puteti contribui la furnizarea de informatii suplimentare privind siguranta acestui medicament.
5. Cum se pastreaza Imarsa
Nu lasati acest medicament la vederea si indemana copiilor.
Nu utilizati acest medicament dupa data de expirare inscrisa pe cutie si pe eticheta seringii dupa EXP. Data de expirare se refera la ultima zi a lunii respective.
A se pastra si transporta la frigider (2°C – 8°C).
Variatii de temperatura in afara limitelor cuprinse intre 2°C si 8°C, trebuie sa fie limitate. Acest lucru include evitarea depozitarii la temperaturi de peste 30°C si nedepasirea unei perioade mai mari de 28 zile in cazul in care temperatura medie de pastrare a medicamentului este sub 25°C (dar peste 2°C - 8°C). In urma expunerii la variatiile de temperatura, medicamentul trebuie stocat cat mai repede la conditiile de depozitare recomandate (a se pastra si transporta la frigider la 2°C - 8°C). Variatiile de temperatura au un efect cumulativ asupra calitatii medicamentului, iar perioada de 28 zile nu trebuie sa fie depasita pe durata perioadei de valabilitate a Imarsa. Expunerea la temperaturi mai mici de 2°C nu va deteriora medicamentul, cu conditia ca acesta sa nu fie depozitat la temperaturi sub -20°C.
A se pastra seringa preumpluta in ambalajul original, pentru a fi protejata de lumina.
Personalul medical va fi responsabil de pastrarea, utilizarea si eliminarea corecta a Imarsa.
Acest medicament poate prezenta un risc asupra mediului acvatic. Nu aruncati niciun medicament pe calea apei sau a reziduurilor menajere. Intrebati farmacistul cum sa aruncati medicamentele pe care nu le mai folositi. Aceste masuri vor ajuta la protejarea mediului.
6. Continutul ambalajului si alte informatii
Ce contine Imarsa
- Substanta activa este fulvestrant. Fiecare seringa preumpluta (5 ml) contine fulvestrant 250 mg.
- Celelalte componente (excipienti) sunt: etanol (96%), alcool benzilic, benzoat de benzil si ulei de ricin rafinat.
Cum arata Imarsa si continutul ambalajului
Imarsa este o solutie vascoasa, limpede, incolora pana la galbena, intr-o seringa preumpluta, prevazuta cu un sistem de inchidere cu sigiliu, continand 5 ml de solutie injectabila. Pentru a se obtine doza lunara recomandata de 500 mg trebuie administrat continutul a 2 seringi.
Imarsa se prezinta sub 3 forme de ambalare, un ambalaj continand o seringa preumpluta din sticla, un ambalaj continand 2 seringi preumplute din sticla si un ambalaj continand 6 seringi preumplute din sticla. De asemenea, sunt furnizate unul, doua sau sase ace cu sistem de siguranta (BD SafetyGlide) pentru a fi atasate la fiecare seringa.
Este posibil ca nu toate marimile de ambalaj sa fie comercializate.
Detinatorul autorizatiei de punere pe piata si fabricantii
Detinatorul autorizatiei de punere pe piata
Gedeon Richter Romania S.A.
Strada Cuza Voda Nr. 99-105
540306 Targu-Mures
Romania
Fabricantul
Laboratorios Farmalan, S.A.
Calle La Vallina, s/n, Edificio 2
Poligono Industrial Navatejera
24193 Villaquilambre, Leon, Spania
Acest medicament este autorizat in Statele Membre ale Spatiului Economic European sub urmatoarele denumiri comerciale:
Bulgaria, Olanda, Romania, Ungaria: Imarsa.
Acest prospect a fost revizuit in februarie 2021. ------------------------------------------------------------------------------------------------------------------------ Urmatoarele informatii sunt destinate numai medicilor si profesionistilor in domeniul sanatatii:
Imarsa 500 mg (2 x 250 mg/5 ml solutie injectabila) trebuie administrat utilizand doua seringi preumplute, vezi pct. 3.
Instructiuni pentru administrare
Avertisment - Nu sterilizati in autoclav acul prevazut cu sistem de siguranta (ac hipodermic cu capac de siguranta BD SafetyGlide) inainte de utilizare. Mainile trebuie mentinute permanent in spatele acului in timpul utilizarii si eliminarii.
Pentru fiecare dintre cele doua seringi
- Luati corpul de sticla al seringii din suport si verificati sa nu fie deteriorat.
- Desfaceti ambalajul exterior al acului prevazut cu sistem de siguranta (BD SafetyGlide).
- Solutiile parenterale trebuie inspectate vizual pentru particule si modificari de culoare inaintea administrarii.
- Tineti seringa in pozitie verticala pe partea striata (C). Cu cealalta mana, apucati capacul (A) si rasuciti cu atentie capacul rigid in sens invers acelor de ceasornic (vezi Figura 1).
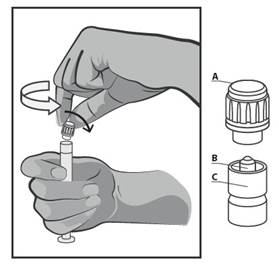
Figura 1
- Inlaturati capacul (A) intr-o directie ascendenta dreapta. Pentru a mentine sterilitatea, nu atingeti varful seringii (B) (vezi Figura 2).
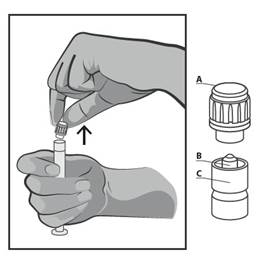
Figura 2
- Atasati acul de siguranta la Luer-Lok si rotiti pana este fixat ferm (vezi Figura 3).
- Verificati daca acul este blocat la conectorul Luer inainte de a trece in plan vertical.
- Trageti capacul de siguranta drept de pe ac pentru a evita deteriorarea varfului acului.
- Duceti seringa umpluta la punctul de administrare.
- Inlaturati capacul acului.
- Eliminati aerul in exces din seringa.

Figura 3
- Administrati intramuscular lent (1-2 minute/injectie) in fesa (zona gluteala). Pentru convenienta utilizatorului, bizoul acului este orientat superior spre bratul parghie (vezi Figura 4).
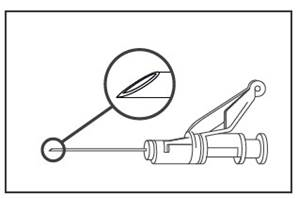
Figura 4
- Dupa injectie, aplicati imediat un singur deget pe bratul parghie asistat de activare pentru a activa mecanismul de protectie (vezi Figura 5).
OBSERVATIE: Activati departe de sine si de altii. Ascultati dupa un clic si confirmati vizual ca varful acului este complet acoperit.
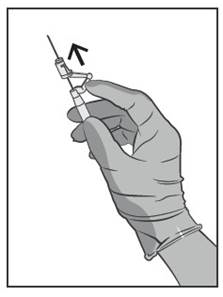
Figura 5
Eliminarea reziduurilor
Seringa preumpluta este numai de unica folosinta.
Acest medicament poate prezenta un risc asupra mediului acvatic. Orice medicament neutilizat sau material rezidual trebuie eliminat in conformitate cu reglementarile locale.
Inapoi la prospecte












